Výsledky léčby přípravkem Mounjaro byly pozorovány již po 4 týdnech a pokračovaly až do 72. týdne1
Pacienti zaznamenali průměrné snížení tělesné hmotnosti o 22,5 % při užívání přípravku Mounjaro 15 mg po 72 týdnech 1,a
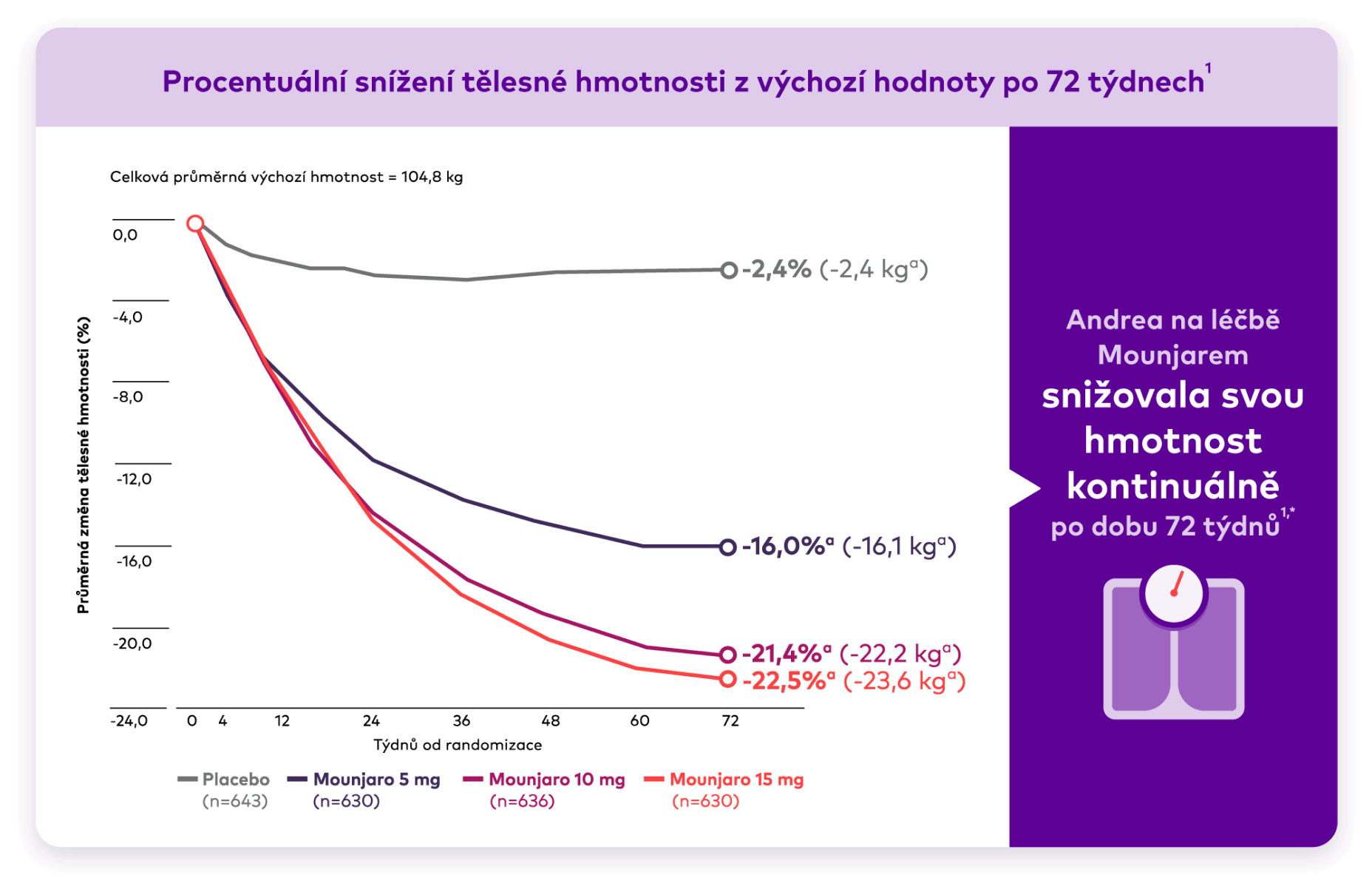
Graf znázorňující průměrnou změnu hmotnosti v průběhu času od výchozího stavu do 72 týdnů. LP Mounjaro 5 mg užívalo 630 osob, 10 mg 636 osob, 15 mg 630 osob a placebo 643 osob. Průměrná výchozí hmotnost byla 104,8 kg. Pozorovaná průměrná procentuální změna hmotnosti v 72. týdnu byla -16,0 %, -21,4 %, -22,5 % a -2,4 % pro Mounjaro 5 mg, 10 mg, 15 mg a placebo.
ap<0.001 vs placebo, upraveno pro multiplicitu.
Odhad účinnosti, analýza MMRM, populace mITT (soubor analýzy účinnosti).
*Zkoumáno u dospělých s obezitou (BMI ≥30kg/m2) nebo nadváhou (BMI ≥27kg/m2) s alespoň jednou komplikací související s obezitou, s výjimkou DM2.1
Všichni účastníci podstoupili intervence týkající se životního stylu, včetně nízkokalorické diety a zvýšené fyzické aktivity. 1
BMI=index tělesné hmotnosti; mITT=populace pacientů, kteří užili alespoň jednu dávku přípravku; MMRM=smíšený model pro opakovaná měření.
DESIGN STUDIE
Přípravek Mounjaro byl hodnocen ve studii fáze 3 po dobu 72 týdnů.1
Do studie SURMOUNT-1 bylo zařazeno 2539 dospělých s BMI ≥ 30 kg/m2nebo BMI ≥ 27 kg/m2a alespoň jednou komplikací související s obezitou, s výjimkou diabetu2. typu. Všichni účastníci podstoupili intervence týkající se životního stylu, diety se sníženým obsahem kalorií a zvýšené fyzické aktivity.1*
KOPRIMÁRNÍ CÍLOVÉ PARAMETRY (10 mg a/nebo 15 mg)2
- Procentuální změna hmotnosti oproti výchozí hodnotě v 72. týdnu
- Procento populace se snížením hmotnosti o ≥5 % v 72. týdnu
KLÍČOVÉ SEKUNDÁRNÍ CÍLE2
- Změna systolického krevního tlaku, inzulínu nalačno a hladin lipidů (triglyceridy, HDL cholesterol, non-HDL cholesterol) od výchozí hodnoty do 72. týdne (všechny dávky dohromady)
- Procento populace se snížením hmotnosti o ≥10 %, ≥15 % a ≥20 % v 72. týdnu (10 mg a/nebo 15 mg)
- Změna obvodu pasu od výchozí hodnoty do 72. týdne (10 mg a/nebo 15 mg)
- Skóre fyzických funkcí v krátkém zdravotním dotazníku o 36 bodech (SF-36), verze 2, akutní forma (10 mg a 15 mg).
- Procentuální změna tělesné hmotnosti oproti výchozí hodnotě a procento populace se snížením hmotnosti o ≥5 % v 72. týdnu (5 mg)
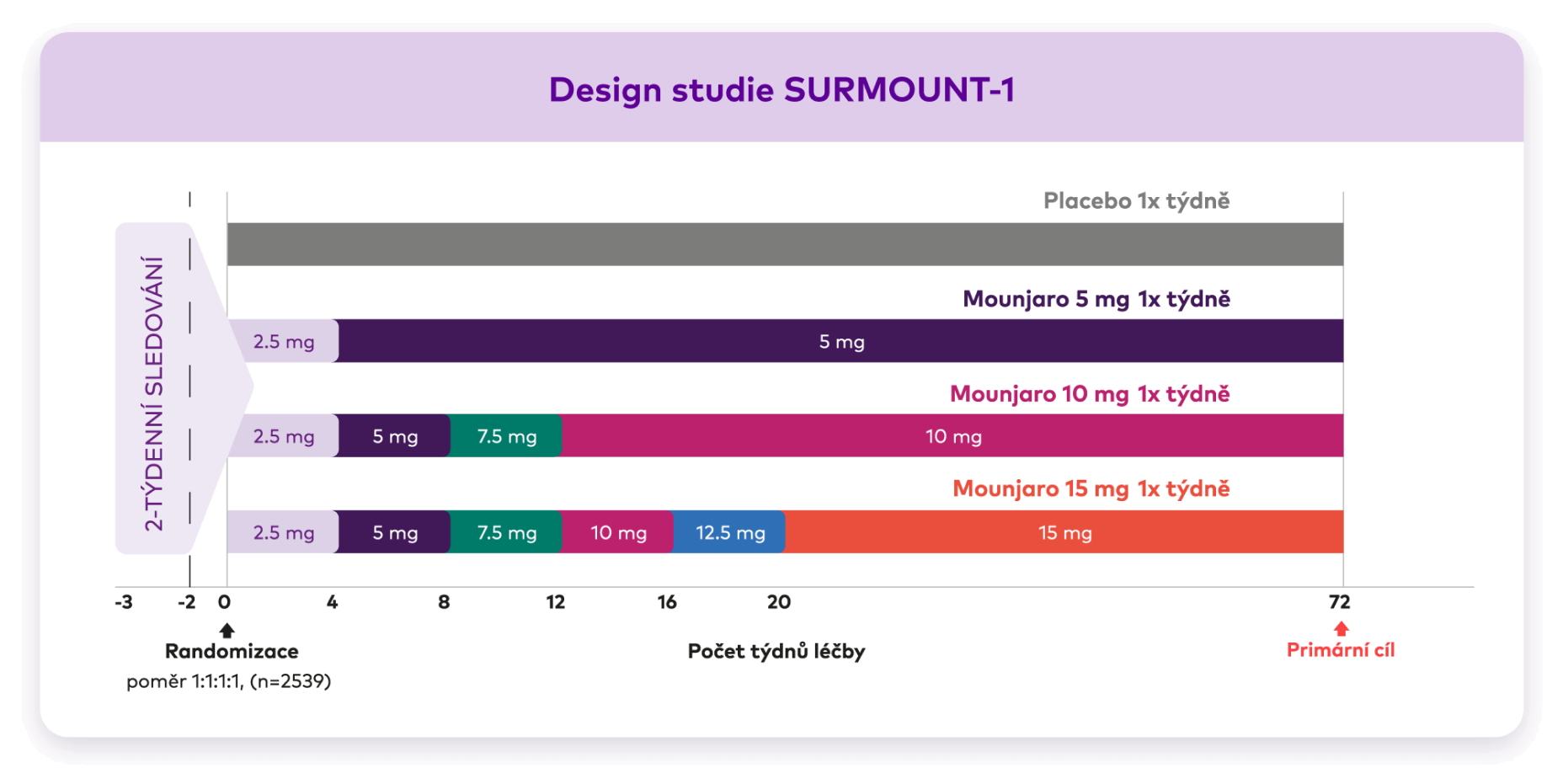
Schéma ukazuje dizajn studie se čtyřmi skupinami účastníků, léčených placebem nebo přípravkem Mounjaro 5mg, 10mg nebo 15mg. Léčba účinnou látkou probíhala dle titračního schématu tj. navyšování o 2,5mg každé 4 týdny do cílové dávky 5, 10 nebo 15mg
*Včetně poradenství dietologa nebo kvalifikovaného zdravotnického pracovníka, denního deficitu 500 kalorií a alespoň 150 minut fyzické aktivity týdně.2
Přípravek Mounjaro a placebo byly podávány subkutánně jako doplněk ke snížené kalorické dietě a zvýšené fyzické aktivitě.2
BMI = index tělesné hmotnosti; HDL = lipoproteiny o vysoké hustotě; QW = jednou týdně.
Podívejte se na významné snížení tělesné hmotnosti s přípravkem Mounjaro
Prozkoumejte další sledované cíleReference:
- SPC Mounjaro
- Jastreboff AM, Aronne LJ, Ahmad NN a kol. Tirzepatid jednou týdně k léčbě obezity. N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
Významné snížení tělesné hmotnosti pomocí přípravku Mounjaro1,2
~4 z 10 osob užívajících přípravek Mounjaro 15 mg vykázaly po 72 týdnech úbytek hmotnosti ≥25 %.2,a
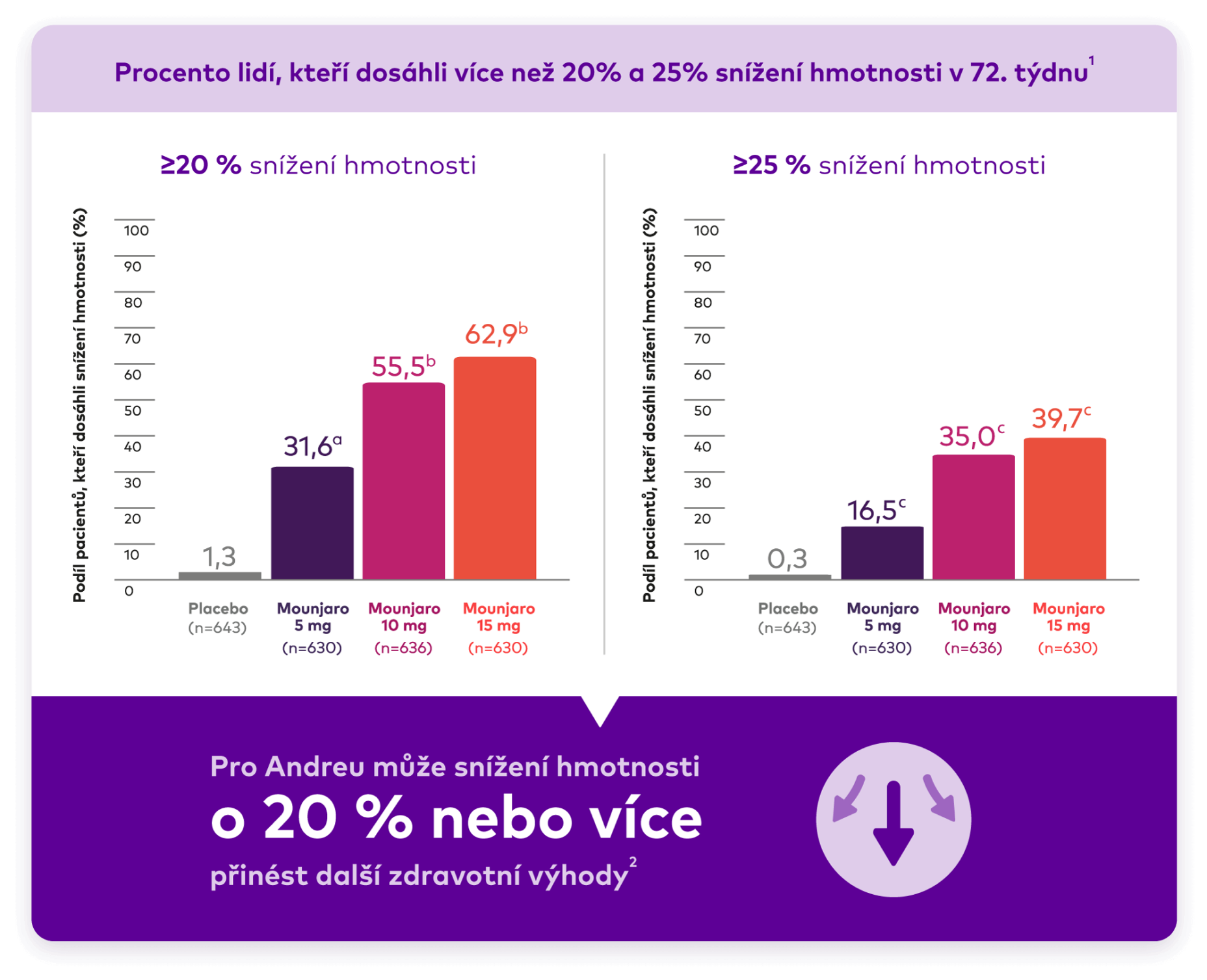
2 sloupcové grafy zobrazující osoby, u nichž došlo ke snížení hmotnosti o ≥ 20 % a ≥ 25 % ve studii SURMOUNT-1. Pro přípravek Mounjaro 5 mg, 10 mg, 15 mg a placebo to bylo 630, 636, 630 a 643 osob. V grafu ≥20 %: Pro přípravek Mounjaro 5 mg byl podíl osob 31,6 %. U přípravku Mounjaro 10 mg byl podíl osob 55,5 %. U přípravku Mounjaro 15 mg byl podíl osob 62,9 %. U placeba byl podíl osob1,3 %. V grafu ≥25 %: Pro přípravek Mounjaro 5 mg byl podíl osob 16,5 %. U přípravku Mounjaro 10 mg byl podíl osob 35,0 %. U přípravku Mounjaro 15 mg byl podíl osob 39,7 %. U placeba byl podíl osob 0,3 %.
aExploratorní cíl, testování hypotéz nebylo provedeno.2
bp<0,001 vs placebo, neupraveno pro multiplicitu.1
cp<0,001 vs placebo, upraveno pro multiplicitu.1
Odhad účinnosti, logistická regresní analýza.2
Studie u dospělých s obezitou (BMI ≥ 30 kg/m2) nebo s nadváhou (BMI ≥ 27 kg/m2) s alespoň 1 komplikací související s hmotností, s výjimkou diabetu 2. typu.1
Všichni účastníci podstoupili intervenci týkající se životního stylu, včetně diety se sníženým obsahem kalorií a zvýšené fyzické aktivity.1
BMI = index tělesné hmotnosti.
U lidí užívajících přípravek Mounjaro došlo ke zlepšení složení těla1
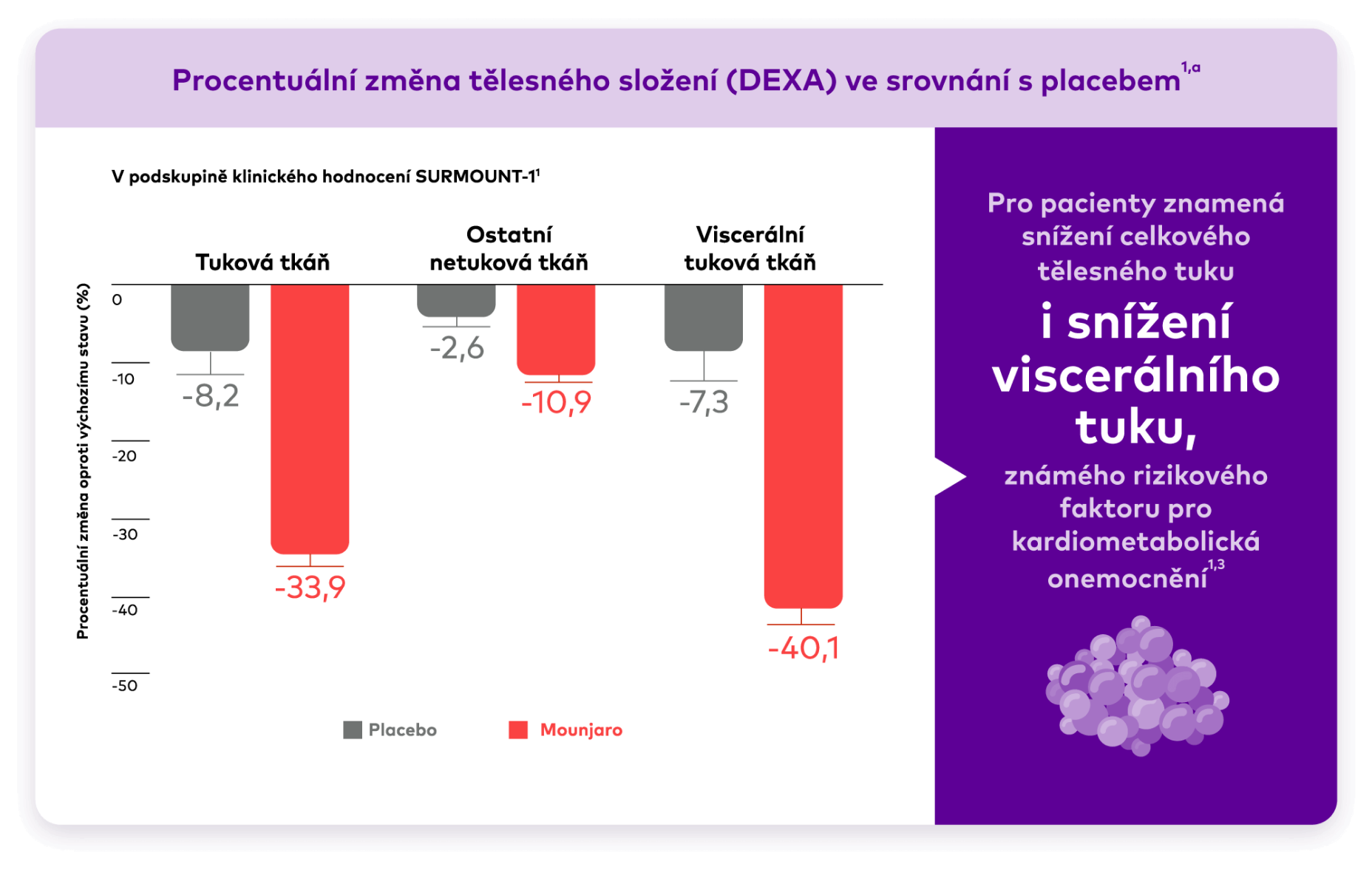
Sloupcové grafy celkové změny tělesného složení, které měří snížení celkové tukové hmoty a celkové ostatní netuková hmoty v procentech oproti výchozímu stavu (přípravek Mounjaro vs. placebo po 72 týdnech). U celkové tukové hmoty došlo u sdružených skupin s přípravkem Mounjaro ke snížení o 33,9 % oproti 8,2 % u placeba. U celkové ostatní netukové hmoty došlo u skupin s přípravkem Mounjaro ke snížení o 10,9 % oproti 2,6 % u placeba.
aSdružené skupiny přípravku Mounjaro a placebo (n=160).2
Údaje od 160 z 255 účastníků v podskupině, která měla hodnotitelné údaje na začátku a v 72. týdnu.2
Studie u dospělých s obezitou (BMI ≥ 30 kg/m2) nebo s nadváhou (BMI ≥ 27 kg/m2) s nejméně 1 komplikací související s hmotností, s výjimkou diabetu 2. typu.1
Všichni účastníci podstoupili intervenci týkající se životního stylu, včetně diety se sníženým obsahem kalorií a zvýšené fyzické aktivity.1
Přípravek Mounjaro a placebo byly podávány subkutánně jako doplněk ke snížené kalorické dietě a zvýšené fyzické aktivitě.2
BMI = index tělesné hmotnosti; HDL = lipoproteiny o vysoké hustotě; QW = jednou týdně,DEXA = dvouenergiová rentgenová absorciometrie
Zjistěte více o individuálním dávkování s přípravkem Mounjaro
Podívejte se na dávkováníReference:
- SPC Mounjaro
- Jastreboff AM, Aronne LJ, Ahmad NN a kol. Tirzepatid jednou týdně k léčbě obezity. N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
- Samms RJ, Coghlan MP, Sloop KW. Jak může GIP zvýšit terapeutickou účinnost GLP-1? Trends Endocrinol Metab. 2020;31(6):410-421. doi:10.1016/j.tem.2020.02.006
Přípravek Mounjaro a komplikace spojené s obezitou
U lidí užívajících přípravek Mounjaro došlo ke zlepšení klíčových kardiometabolických parametrů1,2

Pozorováno v klinické studii SURMOUNT-1 fáze 3 Mounjaro (5 mg, 10 mg, 15 mg) vs. placebo. Jedná se o rozmezí průměrů podle jednotlivých dávkovacích skupin. 2*
Grafické znázornění zlepšení klíčových kardiometabolických parametrů. U systolického krevního tlaku došlo ke snížení o 7,0-8,2 mm Hg ve všech skupinách s dávkou přípravku Mounjaro. U diastolického krevního tlaku došlo ve všech skupinách s dávkou přípravku Mounjaro ke snížení o 4,6-5,5 mm Hg. U obvodu pasu došlo ke snížení o 14,6-19,9 cm ve všech skupinách s dávkou přípravku Mounjaro. U triglyceridů došlo ke snížení o 24,3-31,4 % ve všech skupinách s dávkou přípravku Mounjaro. U HDL cholesterolu došlo ke zlepšení o 7,0-8,6 % ve všech skupinách s dávkou přípravku Mounjaro. U LDL cholesterolu došlo ke snížení o 5,3-8,6 % ve všech skupinách s přípravkem Mounjaro.
*Průměry z každé skupiny jsou průměrné změny podle nejmenších čtverců oproti výchozí hodnotě. Statistické testy byly provedeny pro každou skupinu, nikoliv pro rozmezí od průměrů skupin.2
Odhad účinnosti pro jednotlivé dávky nebyl upraven pro multiplicitu s výjimkou obvodu pasu 10 mg a 15 mg.2
Studie u dospělých s obezitou (BMI ≥ 30kg/m2) nebo s nadváhou (BMI ≥ 27kg/m2) s nejméně 1 komplikací související s hmotností, s výjimkou diabetu 2. typu.1
Všichni účastníci podstoupili intervenci týkající se životního stylu, včetně diety se sníženým obsahem kalorií a zvýšené fyzické aktivity.1
BMI = index tělesné hmotnosti; HDL = lipoproteiny o vysoké hustotě; LDL = lipoproteiny o nízké hustotě.
Podívejte se, jak funguje přípravek Mounjaro
Prozkoumejte mechanismus účinkuReference:
- SPC Mounjaro
- Jastreboff AM, Aronne LJ, Ahmad NN a kol. Tirzepatid jednou týdně k léčbě obezity. N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
Nežádoucí účinky ve studii SURMOUNT-1
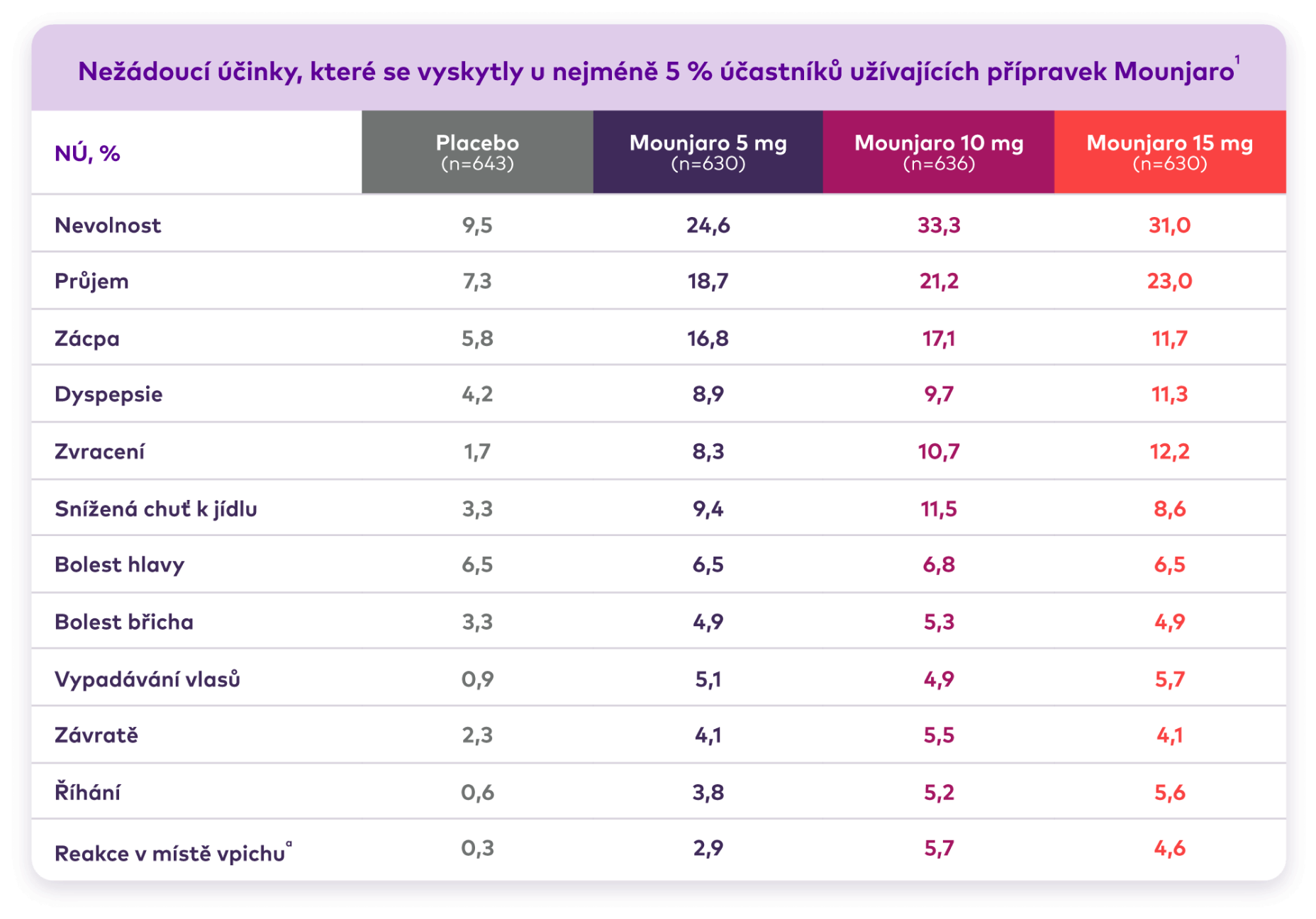
Tabulka nejčastějších nežádoucích účinků při srovnání přípravku Mounjaro a placeba. Ve skupině s 5 mg bylo 630 dospělých, ve skupině s 10 mg 636, ve skupině s 15 mg 630 a ve skupině s placebem 643 dospělých. Míra nevolnosti byla 24,6 % u LP Mounjaro 5 mg, 33,3 % u LP Mounjaro 10 mg, 31,0 % u LP Mounjaro 15 mg a 9,5 % u placeba. Míra průjmů byla 18,7 % u LP Mounjaro 5 mg, 21,2 % u LP Mounjaro 10 mg, 23,0 % u LP Mounjaro 15 mg a 7,3 % u placeba. Míra výskytu zácpy byla 16,8 % u LP Mounjaro 5 mg, 17,1 % u LP Mounjaro 10 mg, 11,7 % u LP Mounjaro 15 mg a 5,8 % u placeba. Míra dyspepsie byla 8,9 % u LP Mounjaro 5 mg, 9,7 % u LP Mounjaro 10 mg, 11,3 % u LP Mounjaro 15 mg a 4,2 % u placeba. Míra zvracení byla 8,3 % u LP Mounjaro 5 mg, 10,7 % u LP Mounjaro 10 mg, 12,2 % u přípravku Mounjaro 15 mg a 1,7 % u placeba. Snížená chuť k jídlu byla 9,4 % u LP Mounjaro 5 mg, 11,5 % u LP Mounjaro 10 mg, 8,6 % u LP Mounjaro 15 mg a 3,3 % u placeba. Bolesti hlavy byly 6,5 % u LP Mounjaro 5 mg, 6,8 % u LP Mounjaro 10 mg, 6,5 % u LP Mounjaro 15 mg a 6,5 % u placeba. Bolesti břicha byly 4,9 % u LP Mounjaro 5 mg, 5,3 % u LP Mounjaro 10 mg, 4,9 % u LP Mounjaro 15 mg a 3,3 % u placeba. Míra vypadávání vlasů byla 5,1 % u LP Mounjaro 5 mg, 4,9 % u LP Mounjaro 10 mg, 5,7 % u LP Mounjaro 15 mg a 0,9 % u placeba. Míra závratí byla 4,1 % u LP Mounjaro 5 mg, 5,5 % u LP Mounjaro 10 mg, 4,1 % u LP Mounjaro 15 mg a 2,3 % u placeba. Míra říhání byla 3,8 % u LP Mounjaro 5 mg, 5,2 % u LP Mounjaro 10 mg, 5,6 % u LP Mounjaro 15 mg a 0,6 % u placeba. Četnost reakcí v místě vpichu byla 2,9 % u LP Mounjaro 5 mg, 5,7 % u LP Mounjaro 10 mg, 4,6 % u LP Mounjaro 15 mg a 0,3 % u placeba.
Nejčastější NÚ byly gastrointestinální (GI) povahy a byly většinou mírné až středně závažné.2
Gastrointestinální nežádoucí účinky se vyskytovaly především během zvyšování dávky a postupem času se snižovaly.2
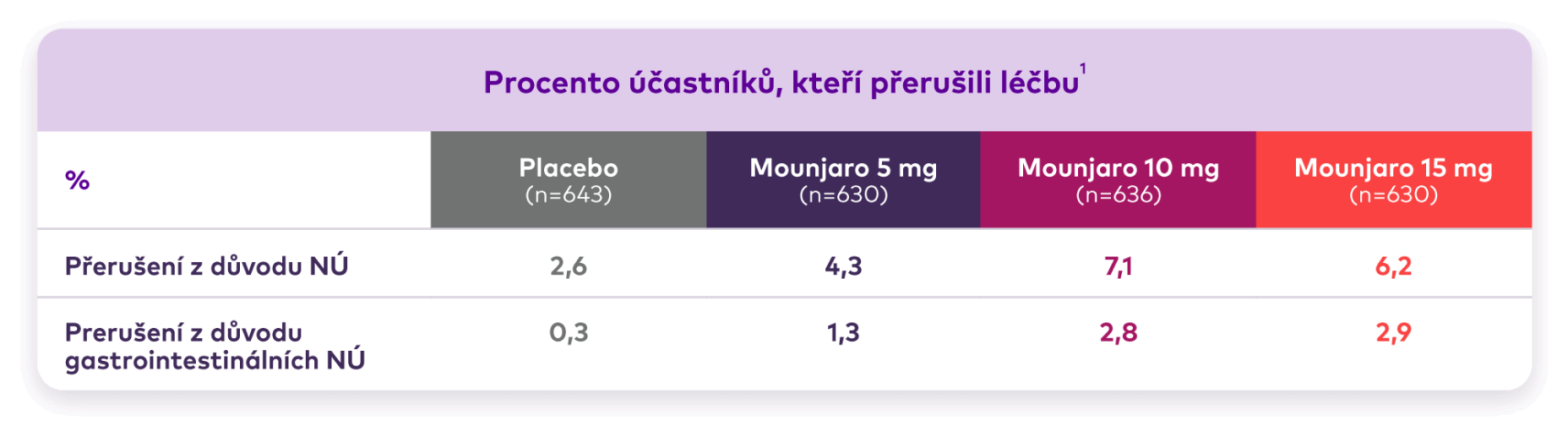
Tabulka přerušení léčby při srovnání Mounjaro vs. placebo. Ve skupině s 5 mg bylo 630 dospělých, ve skupině s 10 mg 636 dospělých, ve skupině s 15 mg 630 dospělých a ve skupině s placebem 643 dospělých. Míra přerušení léčby z důvodu nežádoucích účinků byla 4,3 % u Mounjaro 5 mg, 7,1 % u Mounjaro 10 mg, 6,2 % u Mounjaro 15 mg a 2,6 % u placeba. Míra přerušení léčby z důvodu gastrointestinálních nežádoucích účinků byla 1,3 % u Mounjaro 5 mg, 2,8 % u Mounjaro 10 mg, 2,9 % u Mounjaro 15 mg a 0,3 % u placeba.
aVšichni účastníci klinické studie aplikovali přípravek Mounjaro pomocí injekčního roztoku v jednorázovém automatickém peru.1
Studie u dospělých s obezitou (BMI ≥ 30kg/m2) nebo s nadváhou (BMI ≥ 27 kg/m2) s nejméně 1 komplikací související s hmotností, s výjimkou diabetu 2. typu.2
Všichni účastníci podstoupili intervenci týkající se životního stylu, včetně diety se sníženým obsahem kalorií a zvýšené fyzické aktivity.2
BMI = index tělesné hmotnosti.
Informace o snížení hmotnosti ve studii SURMOUNT-1
Podívejte se na účinnost přípravku MounjaroReference:
- Jastreboff AM, Aronne LJ, Ahmad NN a kol. Tirzepatid jednou týdně k léčbě obezity. N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
- SPC Mounjaro